 病因
病因
病因:
1.血浆葡萄糖与新生儿的脑发育 葡萄糖是人体能量代谢的重要环节。葡萄糖几乎是新生儿脑耗氧代谢的全部物质。成年人肝脏产生的葡萄糖60%~80%被脑利用,而新生儿80%~100%被脑利用。足月新生儿体重3.5kg时脑重量约为450g,每100g脑组织每分钟利用葡萄糖4~5mg,约为20mg/min,婴儿和儿童每分钟产生影响葡萄糖5~8mg/kg。肝脏生成葡萄糖率为每分钟5~7mg/kg,因此肝脏产生的葡萄糖全都被脑所利用。内源葡萄糖的产生与体重<40kg以内的人和脑生长呈完全的正相关。由于生后第1年脑发育最快,葡萄糖的利用率最大。于生后第1年内发生
低血糖时婴儿脑损伤的程度也最严重,月龄越小婴儿
低血糖的危害性也越大,对脑发育和脑功能的损害也更为重要。
新生儿低血糖时由于肝糖原的储存量有限,为维持脑细胞能量而使脑组织的成分如结构蛋白质、髓鞘等物质裂解,产生氨基酸及酮体等作为脑代谢的物质,因而脑组织被损伤。新生儿脑利用酮体的能力虽然较高,但是产生酮体的量极有限,特别高胰岛素
低血糖时抑制糖原和脂肪的分解,缺乏糖异生的基质,因而对脑损伤更为严重,脑细胞膜功能完全破坏致永久性脑损伤,脑灰质萎缩,脑白质髓鞘减少,脑皮质亦萎缩。
2.病因分类与特点
(1)新生儿期生糖基质不足:
早产婴和低出生体重儿
低血糖发生率高的主要原因是由于肝糖原和肌糖原的储备量不足,体脂成为供应能量的主要物质。由于婴儿小,特别是
早产婴和
未成熟儿或胎盘营养供应受损以及糖异生所需的酶系统发育不充分等是发生
低血糖的主要原因。
多数新生儿的激素水平正常,出生后胰岛素减低,胰升糖素增高,hGH及皮质醇多正常,
未成熟儿以及特别是双胎小婴儿、严重呼吸窘迫综合征、妊娠毒血症母亲的婴儿等由于除肝糖原储存减少外,脂肪储存量亦少,脂肪动员生成的游离脂肪酸和酮体均低,因而易于发生
低血糖。近年来已重视对于新生儿和低出生体重儿提早给予脂肪酸和脂肪食物和其他生糖前体如丙酮酸、乳酸等促进新生儿的糖异生。给这类食物可使糖异生增强血糖增高而防止空腹产生的
低血糖;并防止血糖对糖异生抑制物的反应。现在主张对新生儿尽早喂食,生后4~6h即开始喂食,不能进食的静脉输入葡萄糖按每分钟5~10mg/kg的量输入,必要时可每天给可的松5mg/kg,分3次服或泼地松1~2mg/kg,1次/d,监测并维持血糖浓度。生后3~5天的正常婴儿能自然维持血糖正常。
(2)新生儿高胰岛素血症:
糖尿病母亲的婴儿可有暂时性高胰岛素血症,妊娠
糖尿病的发生率约2%。此类婴儿多较大,多血质,体内储存糖原、蛋白质及脂肪充分。
糖尿病母亲的新生儿出生后有高胰岛素血症同时胰升糖素的分泌减少,与正常新生儿不同。同时由于交感神经兴奋,肾上腺髓质的肾上腺素耗尽,因此内生葡萄糖的产生量减少,因而易于发生
低血糖。
新生儿出生时成红细胞增多症者亦有高胰岛素血症,形体亦较大,其胰岛素分泌增高的机制还未完全明了,可能与溶血产生谷胱甘肽增多有关,因谷胱甘肽使胰岛素的二硫键破裂引起代偿性分泌过高有关。
治疗
糖尿病母亲婴儿需静脉输入葡萄糖液,但高血糖又可引起胰岛素的释放导致
低血糖反跳。因此输注葡萄糖需维持到高胰岛素血症消失,胰岛素降至正常水平,血糖维持在6.7~8.3mmol/L,输入葡萄糖率为每分钟6~10mg/kg,可防止发生
低血糖反跳。但每个患儿的输糖量应根据个体需要进行调整,监测血糖避免发生高血糖使胰岛素分泌又增加。另外对
糖尿病母亲在孕期内血糖应控制达到基本正常,可减少出生婴儿并发症的发生。
(3)婴儿和儿童的高胰岛素血症:高胰岛素血症可发生于任何年龄,新生儿期高胰岛素血症亦可以不是
糖尿病母亲引起的。当临床上婴儿出现
低血糖症状时,如发作性衰弱无力,紧张不安或惊厥发作时,应采血同时测血糖和胰岛素。正常情况当血糖<2.2mmol/L(40mg/dl)时,血胰岛素浓度应<5μU/ml,而不应>10μU/ml。高胰岛素血症婴儿在
低血糖时血胰岛素常>10μU/ml,如反复出现两次以上
低血糖而胰岛素水平高时即可诊断为高胰岛素血症。有的婴儿或儿童较小,不进食即出现
低血糖症状。总之同时有
低血糖和血高胰岛素>10μU/ml时即可诊断为高胰岛素血症。
①Beckwith-Weidemann综合征:本综合征病人约50%有高胰岛素血症,特点是巨大身体和内脏,大舌、小头畸形及脐疝,耳郭外侧或耳垂有裂痕,脑发育落后。高胰岛素血症是由于弥漫性胰岛细胞增生或成胰岛细胞增殖症并有
低血糖,有发生肝母细胞瘤、畸胎瘤等的倾向。
②亮氨酸敏感性
低血糖:过去诊为亮氨酸敏感性
低血糖症的病人由于现代诊断技术的进步大部分确诊为β细胞增生、腺瘤或成胰岛细胞增殖症,使本症的诊断减少。这种病人可能是胰岛细胞成熟障碍综合征(islet cell dysmature syndrome)的一种变异。如病情延续到5~7岁后发生
低血糖时称为亮氨酸敏感功能性高胰岛素血症。特点是食用蛋白质食物及亮氨酸后诱发
低血糖发作。给予低亮氨酸食物或二氮嗪(氯甲苯噻嗪)或加用皮质激素可能控制
低血糖。
(4)内分泌激素的缺乏:皮质醇和生长激素是主要拮抗胰岛素的激素,是维持血糖在体内稳定的重要因素。单纯的
生长激素缺乏或全垂体功能减低者,和(或)ACTH-糖皮质激素不足,使糖原异生的酶活性和基质生成减少,糖异生障碍,空腹时出现
低血糖。
艾迪生病及肾上腺脑白质病等亦可有
低血糖。另外,肾上腺髓质缺乏反应的人当血糖降低时,肾上腺素的分泌不增加,不能促进糖原的分解,以致血糖不能上升,常停留在低水平。胰升糖素缺乏也引起
低血糖。
(5)基质的限制(substrate limited):
①酮症性
低血糖:为儿童
低血糖最常见的病因,多于18个月~5岁起病,至8~9岁自然缓解。病史中有食入少或晚餐未进食,次晨睡眠难以唤醒或发生惊厥。
低血糖时有酮血症及酮尿症,血胰岛素为正常低限5~10μU/ml、过夜后的基础状态是血中丙氨酸明显减低。输入丙氨酸(250mg/kg)后血糖可升高,而血乳酸和丙酮酸基本正常。输入果糖和甘油,血糖也升高。以上均说明是缺乏糖异生的基质。进食后血糖正常,其他代谢和激素均正常。
丙氨酸是惟一的生糖氨基酸。其他氨基酸经代谢后生成丙氨酸。酮症性
低血糖实际是低丙氨酸血症。可能涉及蛋白质复杂代谢的某些过程,主要是肌蛋白分解代谢生成丙氨酸为糖异生的基质。在新生儿期可有暂时性
低血糖史,肌肉组织减少时易发生酮症性
低血糖。8~9岁后自然缓解可能因肌肉量发育增多。另外也有人认为是肾上腺素分泌紊乱的结果,但切除双侧肾上腺用糖皮质激素代替治疗的病人很少发生
低血糖。对于肾上腺素缺乏是酮症性
低血糖的病因还争议很大。
酮症性
低血糖的治疗是给以高蛋白高糖饮食。在
低血糖不发作的间期应经常测尿酮体。如出现尿酮体( )预示数小时后将有
低血糖发生。给含糖饮料,不能耐受时可静注葡萄糖或服用皮质醇治疗一个疗程。
②枫糖尿症:为支链氨基酸代谢中α-酮酸氧化脱羧酶(branched-chain α-keto acid oxidativedecarboxylase)缺乏,支链氨基酸有亮氨酸、异亮氨酸、缬氨酸在血中增多,尿中排出酮酸增多,尿有类似枫糖味。患儿有呕吐、淡漠、嗜睡,肌张力高和惊厥。
低血糖发生前血中亮氨酸增高。
(6)糖原贮积症:糖原贮积症中Ⅰ型、Ⅲ型、Ⅳ型和O型有
低血糖发生。其中以Ⅰ型葡萄糖-6-磷酸酶缺乏较为多见。
①Ⅰ型:为葡萄糖-6-磷酸酶缺乏,是糖原分解和糖异生产生葡萄糖的最后一步所需的酶。此酶缺乏使葡萄糖生成减少。从婴儿早期即有严重的
低血糖和糖代谢紊乱,出现高乳酸血症、血酮体增高、高尿酸血症、酸中毒和肝脏增大。治疗的改进改善了预后。为了避免
低血糖的发生,尽早确诊后给予夜间胃管连续喂食,或日夜均3~4h进食一次。食物成分应以60%~70%的糖及淀粉,少食果糖及半乳糖,蛋白质12%~15%,脂肪15%~25%。夜间鼻管喂养给每天食物总热量的1/3,于8~12h连续缓慢滴入(国外有商品配方),可改善代谢的紊乱和防止发生
低血糖,最近报道用生玉米淀粉糊4~6次/d喂养治疗可改善症状。最终的治疗方法为肝移植。
②Ⅲ型:为脱支酶缺乏,使糖原分解产生葡萄糖减少,但糖异生途径正常,因此
低血糖症状较轻。
③Ⅳ型:为肝磷酸化酶缺乏,可发生于糖原分解中激活磷酸化酶的任何一步,偶有
低血糖发生,肝功有损害。
④O型:为糖原合成酶缺乏,肝糖原合成减少,易发生空腹
低血糖和酮血症,而餐后有高血糖和尿糖。治疗为多次高蛋白饮食,能改善代谢和生长。
(7)糖异生的疾病:糖异生发生障碍可引起
低血糖,常见的有:
①果糖-1,6-二磷酸醛缩酶缺乏:此酶缺乏阻断了糖异生前体转变为果糖-1,6-二磷酸,影响糖异生,可发生空腹
低血糖。肝糖原储备正常时可不发生
低血糖。临床与糖原贮积症Ⅰ型表现相似。治疗应禁止食用含果糖食物,并给低蛋白(12%)、正常脂肪(30%)及高糖类食物,可维持正常生长发育,必要时亦可用夜间胃内滴注食物,防止
低血糖。
②丙酮酸羧化酶缺乏:此酶是作用于丙酮酸转变为乙酰乙酸的重要酶。本病特点为亚急性脑髓鞘病(
subacute encephalomyelopathy),血中乳酸、丙酮酸不能利用,在血中增高,空腹时有轻度
低血糖。
③磷酸烯醇丙酮酸羧激酶(phospho enol pyruvate carboxkinase,PEPCK)缺乏:此酶为糖异生的限速酶。缺乏时发生严重空腹
低血糖。可发生于出生后24h。PEPCK在肝脏总的酶活性正常,但是在线粒体外的胞浆(cytosolic)部分中此酶缺乏,并认为这部分的酶活性对糖异生有重要作用。在肝肾及其他组织PEPCK缺乏时组织有广泛的脂肪浸润是由于乙酰CoA增多使脂肪合成。临床特点为严重
低血糖,血中乳酸、丙酮酸均正常,有轻度
代谢性酸中毒。确诊只有肝活检酶活性测定,临床很少能作出正确诊断。治疗为多次高糖饮食,避免较长时间空腹,有助于糖原合成,因糖原分解正常有一定代偿功能。
(8)脂肪酸氧化的缺陷:脂肪酸氧化为糖异生提供基质对血糖的作用亦很重要。如先天或药物引起脂肪酸代谢缺陷可发生空腹
低血糖。各种脂肪代谢酶的先天缺乏可引起肉毒碱缺乏或脂肪酸代谢缺陷,使脂肪代谢中间停滞,不能生成酮体,出现
低血糖、
肝大、肌张力减低和惊厥等。
长链、中链或短链脂肪酸代谢中乙酰CoA脱氢酶缺乏时血浆肉毒碱亦减低,临床表现类似瑞氏综合征。严重
低血糖昏迷发作,心脏和呼吸抑制,
代谢性酸中毒而无酮症。肌张力低,抽风和带有腐蚀性气味可作为诊断的线索。患儿的生存依赖于酶缺乏的严重程度。脂肪酸代谢障碍的发病率约为1∶15000,有待分子诊断方法的发展,才能使进行新生儿筛查成为可能。
(9)其他酶的缺乏及其他原因:
①
半乳糖血症:为半乳糖-1-磷酸尿苷转移酶缺乏。患儿于食乳后发生
低血糖,半乳糖-1-磷酸不能利用而在体内累积,产生中毒症状,如
腹泻、
肝大、
黄疸、酸中毒,并可引起肾和脑损伤,并抑制肝释放葡萄糖。
②果糖不耐受症:为果糖1-磷酸醛缩酶或是果糖1,6-二磷酸酶的缺陷。婴儿只食母乳,不出现症状,但在添加辅食后因食物中含果糖,不能进行正常代谢,可出现
低血糖、
肝大、
黄疸等。由于糖代谢及脂肪代谢的异常,血中乳酸、酮酸、游离脂肪酸增多,三酰甘油减少。
③其他肝脏的损害:严重的和慢性的肝脏病变(损害超过肝脏80%)可影响糖代谢。急性病毒性肝炎、
肝硬化、肝脏中毒及其他肝、胆疾病皆可引起
低血糖。年幼儿患瑞氏(Reye)综合征,发生脑病伴有肝脂肪变,亦可有
低血糖。
④药物中毒:
A.急性酒精中毒,儿童很少见。多因葡萄糖利用增加,并干扰糖异生,可致
低血糖。
B.柳酸盐中毒,柳酸盐使胰岛素分泌增加引起
低血糖。
⑤小肠吸收减少:如慢性
腹泻、吸收不良综合征、肾病的水肿期等,均可使小肠吸收功能发生障碍,空腹不超过24h即可出现
低血糖发作。
⑥难控制的
低血糖发作:曾有报告2例婴儿有难控制的
低血糖发作症状,
低血糖发作时脑脊液中葡萄糖减低乳酸减低而血糖正常。正常脑脊液葡萄糖与血糖的比例为0.8,病人为0.2~0.4,经红细胞检查发现红细胞葡萄糖转运蛋白有缺陷,提示脑脊液葡萄糖转运可能有同样缺陷,有待进一步证明。婴儿和儿童
低血糖的分类见表1。
 发病机制
发病机制
发病机制:
1.基质、能量和激素对血糖稳定的机制 胎儿血葡萄糖浓度虽和母亲血糖相似(相当于母血的80%),但二者血糖调节的机制却不完全相同。胎儿血糖不是依赖激素的调节,母亲血糖急剧的降低或升高,都不发生胎儿激素分泌的变化。但胎儿在长期高血糖环境中时胰岛素分泌增多使血糖下降,反之在母亲慢性饥饿处于血糖偏低的状态时,胎儿胰岛素分泌减少和胰升糖素增多。胎儿对血糖变化的迟缓反应是与胎儿体内激素受体产生的cAMP和酶系统不成熟有关,有的迟缓反应可延长至新生儿期。
胎儿出生离开母体后,母血中葡萄糖停止供应,出生后需动员新生儿自身内在的葡萄糖,这种变化需要有激素、激素受体和关键酶活性的变化,以及有适当的合成葡萄糖的基质。新生儿出生后数小时内胰升糖素分泌急剧增高达5倍,同时胰岛素下降至正常基础值范围。此时儿茶酚胺刺激胰升糖素和GH分泌,抑制胰岛素分泌,三者相互关联。因此,正常新生儿出生后血中激素是高肾上腺素,高胰升糖素和高生长激素及低胰岛素状态,并有皮质醇增高。这些激素使糖原分解,产生葡萄糖,脂肪分解产生脂肪酸、酮体和甘油,肌蛋白分解产生丙氨酸,提供糖异生的基质生成葡萄糖。激素的变化使出生后血糖暂时的下降后能迅速上升而血糖稳定。但新生儿肝脏糖原储备有限,占新生儿生后数小时内生葡萄糖的10%,很快被耗尽。由于丙氨酸经糖异生产生葡萄糖,脂肪分解的酮体亦可被脑利用。
出生后激素的变化是由于生后激素受体的变化而产生的。生后胰岛素受体下降而胰升糖素受体剧增,同时产生葡萄糖的关键酶如磷酸化酶和磷酸烯醇丙酮酸羧激酶(phospho enol pyruvate carboxykinase,PEPCK)出生后活性大增,后者为糖异生的限速酶。这些变化是使新生儿血糖能迅速恢复正常的关键。
1岁以上婴儿血糖的调节和成人相同。体重10kg婴儿肝糖原储存量为20~25g,可以供给每分钟4~6mg/kg的葡萄糖达6~12h,肝糖异生也活跃。但是糖异生的基质主要是来源于肌蛋白产生的丙氨酸,婴儿及儿童的肌肉组织相对比成人少,因此由糖异生产生葡萄糖的能力亦有限。特别是有氨基酸代谢障碍时,只有脂肪代谢产生酮体,因此极容易发生酮症。
(1)激素对血糖稳定的调节:
①胰岛素:胰岛素是体内惟一降
低血糖的激素。其作用为刺激葡萄糖的利用和抑制葡萄糖的产生。胰岛素抑制肝糖原的分解和刺激肝糖原的生成是降
低血糖的主要机制,同时增加末梢组织主要是肌肉摄取葡萄糖合成肌糖原;促使脂肪组织合成脂肪,葡萄糖的利用增加,使血糖降低;胰岛素还促进蛋白质的合成。胰岛素对于糖异生、脂肪分解和酮体的产生都有较强的抑制作用。
②升高血糖的激素:有数种激素促进血糖的升高,防止在空腹状态时发生
低血糖而维持血糖的稳定。这些激素有胰升糖素、肾上腺素、生长激素和皮质醇,统称为反调节激素。
A.胰升糖素对
低血糖最敏感,抑制肝脏和组织摄取葡萄糖和促进糖原分解,增加糖异生和抑制葡萄糖的酵解使血糖增高。
B.肾上腺素、儿茶酚胺刺激糖原分解,脂肪分解和增加糖异生,肾上腺素还刺激胰升糖素和GH的分泌增加,增强生糖作用。
C.生长激素对糖代谢的作用较复杂。hGH急性分泌时有类胰岛素作用,降
低血糖。持久分泌增多引起高血糖和促进糖异生的作用。
D.皮质醇增加糖异生,脂肪分解产生酮体和蛋白质分解,提供糖异生的底物。皮质醇可使胰岛素的敏感性降低,有直接拮抗胰岛素的作用。
(2)综合反调节激素升高血糖的作用机制:
①激活糖原分解和糖异生酶活性的为胰升糖素和肾上腺素。
②增加糖异生的酶活性有胰升糖素和皮质醇。
③抑制末梢摄取葡萄糖的有肾上腺素、生长激素和皮质醇。
④使肌蛋白分解提供糖异生的氨基酸为皮质醇。
⑤所有反调节激素均有激活脂肪分解产生甘油以供糖异生和脂肪酸产生酮体。
反调节激素的作用之间的相互作用是有先后的不同。肾上腺素和胰升糖素作用快,肾上腺素和胰升糖素之间对葡萄糖的代谢有相互代偿的作用。生长激素和皮质醇之间亦有部分相互代偿的作用。多种反调节激素缺乏如全垂体功能减低时发生的
低血糖严重并出现时间亦早。关于糖原分解和糖异生的代谢步骤和关键性酶。
2.肝脏对糖代谢的调节 肝脏在激素的作用下影响糖代谢酶的活性。肝糖代谢酶受以上各激素的激活或抑制而影响血糖的水平。但原发性肝脏代谢酶的缺陷如糖原贮积症的一些酶缺乏也是产生
低血糖的原因。
 鉴别诊断
鉴别诊断
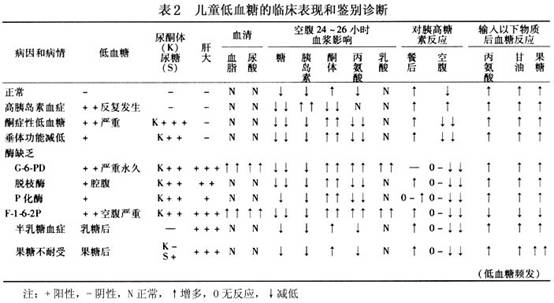
鉴别诊断:确诊
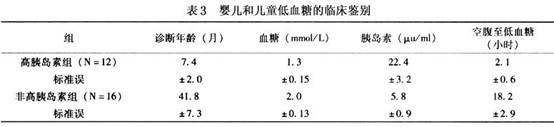
低血糖为高胰岛素血症或非高胰岛素血症鉴别的临床和化验检查见表3。
诊断高胰岛素血症后需进一步鉴别引起高胰岛素血症的病理,是成胰岛细胞增殖症(nesidioblastosis)还是β-细胞增生(β-cell hyperplasia)或胰岛细胞腺瘤,三者的鉴别在于胰岛素的分泌状态和病理检查。胰岛细胞腺瘤主要是胰岛素的自主性分泌,胰岛素间断的释放与血糖浓度无相互关系。β细胞增生只是胰岛分泌胰岛素的β细胞增生,而成胰岛细胞增殖症是指胰腺管内有胰岛的4种细胞存在,是分散的单个细胞或成细胞簇存在或成腺样组织,为未分化的小胰岛或微腺瘤。有时腹部CT可发现胰岛细胞腺瘤或超声波的腺瘤回声图可能有时对诊断有帮助。但婴幼儿的高胰岛素血症多数是细胞增生引起的,真正的鉴别是靠病理组织的检查。
1.高胰岛素血症 肝脏不大或轻微增大,
低血糖但无明显酮尿或酮血症的病人,最好于
低血糖时采取一系列血液标本,测定葡萄糖和胰岛素。如血浆胰岛素浓度>10µU/ml,而血糖浓度<50mg/dl,不论禁食时间长短,均为高胰岛素血症表现。这类患儿于
低血糖时,静注胰高血糖素0.03mg/kg,10~20min内如出现明确的血糖效应(<20~30mg/dl),显示肝内有相当量的糖原存储,高度提示为高胰岛素血症或胰高血糖素缺乏。
2.酮症性
低血糖 两岁以后出现伴有酮症的空腹
低血糖,肝脏不大,为酮症性
低血糖表现。疑为酮症性
低血糖的任何病儿,应于诊断禁食结束时,采留尿标本进行尿内异常有机酸的筛查。
3.
半乳糖血症或遗传性果糖不耐受症 病儿常有肝脏肿大和生长障碍,饭后出现
低血糖。进食含半乳糖或果糖食品后,尿中出现非葡萄糖还原物质。确诊
半乳糖血症,有赖于测定红细胞内1-磷酸半乳糖尿苷转移酶活性。应避免半乳糖耐量试验,以免引起严重
低血糖。对临床疑为果糖不耐受症的病儿,可审慎的静脉输果糖(0.25g/kg),如出现
低血糖和低磷酸盐血症等效应,高度支持果糖不耐受症的诊断。静脉用药可防止口服引起恶心、呕吐等不愉快反应。
 治疗
治疗
治疗:治疗目的在于预防惊厥,防止神经系统永久性后遗症,杜绝死亡。防止新生儿发生低血糖及其引起脑发育障碍的后果是极为重要的。
1.紧急处理 病情危重,初步检查符合低血糖的病儿,应于采取各项化验标本后,立即快速静脉输入25%
葡萄糖液(0.5~0.1g/kg)。症状控制后改用10%~15%
葡萄糖液,并逐步减慢输入速度。此后根据血糖监测结果,调整给糖量,以使血糖维持在40~120mg/dl为度。治疗过程中,随时监测尿糖,避免血糖过高出现糖尿,引起利尿。
新生儿期低血糖高胰岛素血症时,开始可用10%
葡萄糖静脉推入2ml/kg,然后以每分钟6~8mg/kg速度滴入。加用胰升糖素,二氮嗪(氯甲苯噻嗪)等治疗后,不能阻止低血糖的发生时加用糖皮质激素。近来用重组D
NA合成
生长抑素类似物。
不具备输液条件时,可用胰血糖素0.03mg/kg,最多不超过1mg,或1∶1000肾上腺素0.01mg/kg,肌内或皮下注射。此类药物作用时间短暂。病儿一旦清醒,应立即经口喂食,以维持血糖有效浓度。肝糖原分解或糖异生障碍病儿,如糖原累积病或低出生体重儿,胰血糖素不能使血糖上升。
经以上处理,低血糖如仍不见好转,可加用氢化可的松每天5mg/kg或泼尼松(强地松)每天2mg/kg。一旦血糖恢复正常,即逐渐减量。
2.长期处理 应针对病因,采取相应措施。
(1)一般治疗:对低血糖高危的新生儿,如胎龄小样儿、糖尿病母之婴儿等,应于出生后监测血糖数值。临床情况许可时,尽量自生后4~6h开始喂奶。此后每2~3小时喂奶1次。
(2)激素替代治疗:缺乏糖皮质类固醇、
生长激素或甲状腺激素引起的低血糖,可予以相应的激素替代治疗。但对其他原因引起的低血糖,不可常规使用甲状腺素。长期皮质类固醇治疗,不但影响生长,且易出现其他副作用。
(3)饮食疗法:对多数先天性代谢障碍引起的低血糖有效。半乳糖血症或果糖不耐症,停用半乳糖或果糖后,症状缓解,预后改善。枫糖尿患儿,改用无或低分支氨基酸饮食后,临床好转。糖原贮积病、
葡萄糖-6-磷酸酶缺乏等碳水化合物代谢障碍病引起的低血糖,采用日间每2~3小时进淀粉或
葡萄糖液1次,夜间经鼻胃管持续滴注
葡萄糖液(每分钟8~14mg/kg),有显效;并使高脂、高尿酸、乳酸和酮酸血症有改善;肝大虽仍持续,但生长速率增快。远期后果尚有待进一步随访观察。果糖1,6-二磷酸酶缺乏病儿,用含碳水化合物(
葡萄糖、
麦芽糖、乳糖等)50%~60%,蛋白质10%~12%和脂肪30%的饮食,可有效地控制低血糖和乳酸酸中毒,并使生长发育达到正常。但遇应激状态分解代谢增快时,可能出现危及生命的乳酸酸中毒、酮症酸中毒和低血糖,应住院静脉输
葡萄糖治疗。诊断系统肉毒碱、肉毒碱酰基转移酶或者HMG
CoA裂解酶缺乏等脂肪酸代谢缺陷的病人,注意避免任何期限的饥饿。遇分解代谢增多的应激情况时,频给高碳水化合物饮食。如不能口服,可静脉输入
葡萄糖,速率以保持血糖浓度正常,抑制脂肪分解为度[5~7mg/(kg·min)]。酮症性低血糖病儿,可每天小量频餐高蛋白、高碳水化合物饮食4~5次,防止出现低血糖。低血糖往往出现在感染或饥饿持续12h以上时。低血糖出现前尿酮体先增多,因此一旦尿酮体阳性,应立即开始口服或静脉输
葡萄糖液。
3.高胰岛素血症的婴儿
(1)3个月以内的婴儿:诊断为高胰岛素血症的婴儿治疗原则,在生后3个月以内的,建议尽早剖腹探查。未发现腺瘤时切除85%~90%的胰腺组织。
内科治疗不满意,年龄已过新生儿期的患儿,应行胰腺探查术。手术危险既小,又可采取足够的诊断所需组织。倘发现腺瘤,局部切除可以根治。经仔细触摸、探查未发现肿物的患儿,可行胰腺次全切术(80%~90%)。术后用短程胰岛素控制高血糖,并长期随访,以判断手术对胰腺内外分泌功能的影响。
(2)3~6个月以上的婴儿:可试用二氮嗪(氯甲苯噻嗪,降压嗪)每天5~15mg/kg,分2~3次口服,抑制胰岛素的分泌。同时多次喂食2~4周,如能使血糖维持正常可坚持治疗。必要时加用氢化可的松(皮质醇)。但药物副作用多,包括多毛、水肿、电解质紊乱和骨龄增速等。如仍有低血糖发作则应早手术,避免反复低血糖发作以引起脑损伤。对于成胰岛细胞增殖症近年报告有用
生长抑素(Somatostatin)及其类似物治疗能抑制胰岛素的释放和纠正低血糖,长期治疗有获得成功的报告。
(3)持续性高胰岛素血症病儿:经激素和饮食处理无效时,可试用二氮嗪(降压嗪)每天10~15mg/kg,抑制胰岛素的分泌并刺激肝糖释放,以提高血糖。但效果不肯定,且常有血压降低的副作用。内科治疗不满意,行胰腺探查术,切除腺瘤或行胰腺次全切术,术后用短程胰岛素控制高血糖,必要时仍需频餐并用二氮嗪(Diazoxide)治疗。如低血糖仍不能控制,可再次行胰腺全切术。对外科手术后出现的低血糖,术前应尽可能的缩短禁食时间。术后适当地进行血糖监测,必要时静脉输入
葡萄糖。
4.
奥曲肽(Octreotide)可以有效地控制低血糖 以皮下注射
奥曲肽(Octreotide)20~50μg,每6~12小时1次。但有抑制生长的副作用。
生长抑素类似物常用于高胰岛素血症剖腹手术前,其他低血糖的治疗均在病因中说明。
总之,随着对
葡萄糖内平衡过程认识的提高,已有可能逐步从病理生理的基础上,诊断儿童期低血糖,并制订比较合理的治疗方案。目前,对这方面的了解还远不够全面。对婴儿和儿童代谢底物内平衡的研究,有可能澄清
葡萄糖内平衡方面目前尚未解决的一些临床问题,有助于建立新的特异性诊断方法,并改进对这类病儿的治疗。
 预防
预防
预防:
1.预防
新生儿低血糖 新生儿大脑发育快,需要消耗大量的葡萄糖,如果来源不足或生成障碍,导致
低血糖往往造成严重后果,轻者智力发育迟缓,重者可出现
智力低下、白痴,甚至发生
脑性瘫痪等疾病。血糖浓度越低,持续时间越长,脑损伤程度越重。因此,预防
低血糖是一个不可忽视的问题。
(1)加强血糖监测:
新生儿低血糖在早期(血糖在1.7~2.2mmol/L)往往无症状,但可能引起脑的损伤,因此,在新生儿出生后的24h内,必须加强血糖的监测,最早1次应在出生后的30min进行,随后可根据实际情况,在第1,2,4,6个小时各检查一次。如果发现血糖低于2.2mmol/L就应给予补充葡萄糖。
(2)孕妇合理进食:对于
新生儿低血糖,预防是首要因素,这比治疗更为重要。孕妇合理进食是预防
新生儿低血糖的关键措施。自然分娩的产妇在产程前后应适当进食,少食多餐,以富含热量的流食、半流食为主,如果汁、藕粉、稀面条、稀饭等。
(3)补充葡萄糖:当产妇因情绪紧张、焦虑而缺乏食欲或畏惧进食时,可给予5%~10%葡萄糖静脉注射。剖宫产的新生儿较自然分娩的新生儿更容易出现
低血糖,这与孕妇禁食时间长和术中补盐多于补糖有关。对此,术前给孕妇注射5%~10%葡萄糖,可提高其产时血糖浓度,有利于改善宝宝对糖的需求。
(4)及早开奶:此外,无论是自然分娩还是剖宫产的产妇,都应及早开奶,尽可能在产后30min内就给孩子喂奶,同时产妇也应根据自身情况尽早进食,以降低
新生儿低血糖的发生。
2.摄入足够的糖 预防
低血糖的发生就要摄入足够的糖。对于小儿,应根据其年龄特点、生理特点,定时、定量地合理安排一天的饮食。如对于刚出生的婴儿要在生后尽早哺喂母乳,促进母亲乳汁分泌,保证母乳喂养;对于1岁的小儿,饮食要多样化、营养丰富易消化,最好每天安排三餐二点较为适宜。这样可以保证有足够的糖摄入。
3.预防
糖尿病患儿发生
低血糖 用过多的胰岛素、过量的运动、进食太少、误餐、疾病或饮酒是
糖尿病患儿发生
低血糖的常见原因,尤其是格列本脲(优降糖)使用过量或应用不当问题。对
糖尿病并发
低血糖可采取如下预防措施:
(1)掌握饮食治疗方法:注意卫生宣教,使病人了解
糖尿病常识。在内分泌专科医生的指导下长期坚持饮食治疗, 学会掌握饮食治疗的方法。
(2)学会监测方法:学会做尿糖测定。
(3)学会使用降糖药:学会使用降糖药及了解使用降糖药的注意事项,尤应学会注射胰岛素技术,应严格计算好胰岛素与精蛋白锌胰岛素的用量比例。严密观察口服降糖药的使用,发现
低血糖反应时,及时调整。
(4)生活有规律,注意个人卫生,防止各种感染。
(5)坚持体育活动, 避免过累及剧烈运动。
(6)如果发现白天尿量多,尿糖多时,夜间常发生
低血糖时,应检查注射部位是否吸收不良而引起,改变注射部位。



 流行病学
流行病学
 病因
病因

 发病机制
发病机制
 临床表现
临床表现
 实验室检查
实验室检查
 其他辅助检查
其他辅助检查
 诊断
诊断
 鉴别诊断
鉴别诊断
 治疗
治疗
 预后
预后
 预防
预防